Nos résultats
Nous sollicitons nos vétérinaires prescripteurs pour être informés de leur retour d’expérience à l’issue des différentes phases de traitement. Certaines équipes en France ou à l’International publient ces travaux et démontrent l’innocuité et l'efficacité clinique du traitement APAVAC.

Lymphome B diffus à grande cellules
Deux séries de 150 chiens atteints d'un lymphome (de type LBDGC) ont été traités par chimiothérapie et par chimiothérapie associée au traitement APAVAC (chimio-immunothérapie). L'étude réalisée et publiée par une équipe universitaire du centre Oncologique Vétérinaire de Bologne confirme l'absence d'effets secondaires liés à l'immunothérapie APAVAC et démontre un bénéfice en termes de réponse et de survie lorsque la chimiothérapie est associée à l'immunothérapie.
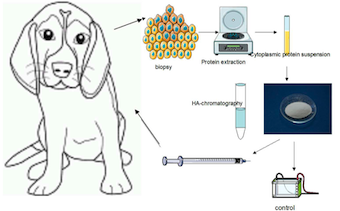
Lymphome Non Hodgkinien du chien
Un groupe de chien a été traité par immunothérapie seule. La bonne survie globale et les résultats préliminaires montrent que cette technique est réalisable en médecine vétérinaire privée. L'association des particules d'Hydroxyapatite aux antigènes associés aux tumeurs et aux HSP n'a pas déclenché d'effets indésirables. Cette technique pourrait également être combinée à une chimiothérapie ou radiothérapie conventionnelle pour augmenter la survie globale de l'animal.
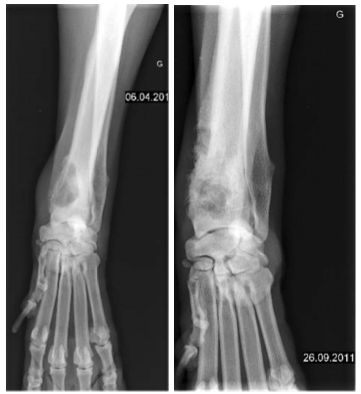
Osteosarcome canin
Bien que cette série soit courte, le traitement APAVAC de stimulation du système immunitaire améliore le pronostic des ostéosarcomes canins avec ou sans amputation. Nous n'avons pas noté d'effets secondaires en particulier de nature auto-immune. L'amélioration est plus sensible lorsque les chiens sont amputés. Ces résultats ont été obtenus sans chimiothérapie associée. Nous pouvons donc penser que la combinaison de traitements cytotoxiques pendant une fenêtre thérapeutique préservant l'immunité de l'animal pourrait amplifier l'amélioration de la survie globale.

Carcinome mammaire félin
Cette étude (en cours de publication) a pour but d'évaluer prospectivement l'efficacité et les effets secondaires du traitement APAVAC, associé à du cyclophosphamide métronomique comme traitement adjuvant du carcinome mammaire du chat. 18 chattes (âge moyen de 10,2 ans) présentant des tumeurs mammaires de grade II ou III, des métastases ganglionnaires et sans maladies concomitantes ont été recrutées. Après excision chirurgicale, le prélèvement a été utilisé pour la fabrication de l’immunothérapie, associée au cyclophosphamide oral (15mg/m2 tous les jours). On observe une amélioration de la survie par rapport aux études rétrospectives du carcinome mammaire avec une durée médiane de survie de 620 jours et l’absence de toxicité importante associée. Ils concluent que cette association représente une alternative à développer particulièrement pour les carcinomes agressifs.

Mastocytome canin
Un labrador et un boxer atteints respectivement de Mastocytome de grade II et III selon Partnaïk, ont été traités après chirurgie réductrice à marges saines, par immunothérapie autologue APAVAC préparée à partir des prélèvements. Aucune autre chimiothérapie n’a été associée. La survie a atteint 835 jours (Labrador, grade II) et 462 jours (Boxer, grade III) sans aucune récidive, ni effet secondaire. Ces données, bien que considérées comme cas cliniques isolées, confortent l’efficacité du traitement APAVAC comparée aux données de la littérature qui rapportent jusqu’à 30 % de récidives en Phase II et 100 % de métastases en phase III (selon Biller dans 2016 AAHA Oncology Guidelines for Dogs and Cats).
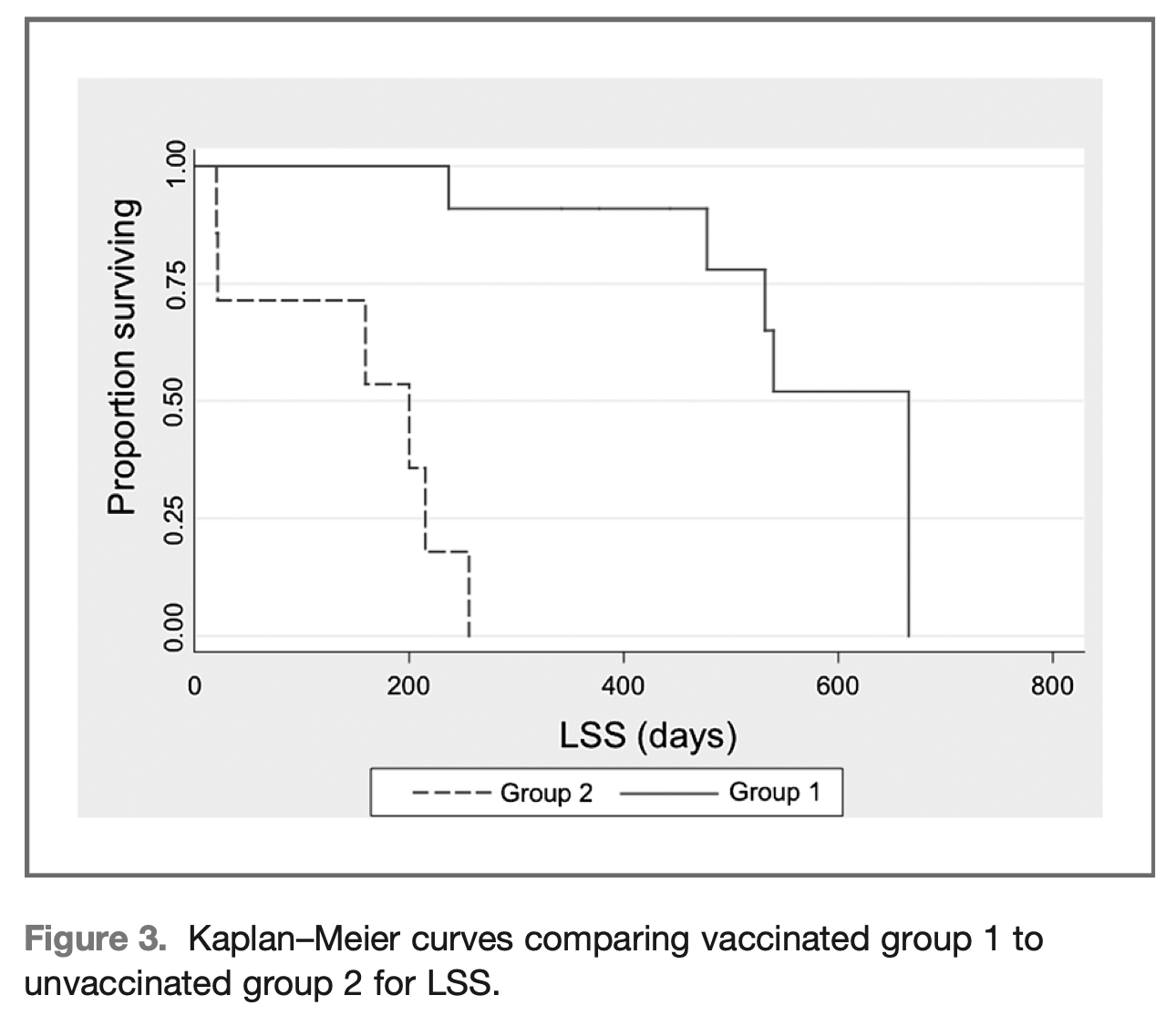
Lymphome canin
A 5 ans de recul, la survie spécifique au Lymphome moyenne (animal non décédé du lymphome) a doublé pour les chiens ayant bénéficié du traitement APAVAC par rapport aux chiens traités par chimiothérapie seulement. Les résultats de cet essai indiquent la faisabilité, une bonne tolérance et une puissante activité immunologique de la stratégie de vaccination autologue testée, conduisant à une amélioration de la survie et l’absence de progression de la maladie chez les chiens traités par Immunothérapie APAVAC en complément d’une chimiothérapie conventionnelle.